
 2025-03-26
16:08:40
2025-03-26
16:08:402025年3月,ISO 15223-1:2021标准发布了一项修正案,此次修订对医疗器械产品使用的授权代表标识及术语进行了重要更新。
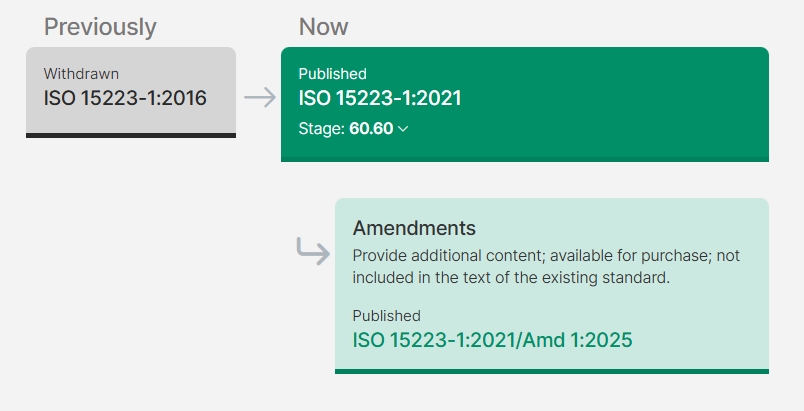
我们带您简单了解一下标准更新内容:
1、增加“授权代表”(Authorized Representative)的定义。
这个定义与法规MDR和IVDR中的描述非常相似,但又略有不同:
-它没有限制授权代表的区域,意即这个名词可以用于欧盟以外地区。
-它没有限制厂商的区域,意即厂商或许可以使用与自己同一个国家的授权代表,只要本国法规允许。
这个宽泛的定义无疑给了授权代表一词很大的应用空间。
2、变更“授权代表”的标识及其使用范围。
| 旧标识 | 新标识 |
| 欧盟授权代表 | 授权代表 |
 | 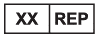 (XX一般指国家/地区代码) (XX一般指国家/地区代码) |
曾经的授权代表标识专用于欧盟,用字母EC表示European Community。现在的授权代表标识则可以用于任何国家和地区,只需要在标识前部使用该地区的缩写。例如欧盟缩写为EU,那么欧盟授权代表的标识将变成EU REP: ,瑞士授权代表使用CH REP:
,瑞士授权代表使用CH REP:
针对此次更新,厂商需要做什么?
1、ISO标准已经更新,厂商需要尽快在标签和说明书中使用新欧代标识。
2、如果您正在准备医疗产品的CE认证,请尽快联系您的公告机构或欧代公司讨论新标识的使用。公告机构或欧代公司可能会要求您检查现有注册文件是否符合最新ISO 15223-1:2021/A1:2025标准。
另外,英国法规对于英代的定义是“UK Responsible Person”,并不是“Authorized representative”,大部分企业通常使用UK RP作为英代标识。目前也未有正式官方文件给出英代的标准标识。
至于未来英代标识是否也会使用UK REP呢?让我们拭目以待。
 / 地址:
/ 地址:
 / 电话:
+49251 322 66-64
/ 电话:
+49251 322 66-64  / 电邮:
contact@mednet-ecrep.com
/ 电邮:
contact@mednet-ecrep.com